Capacidad calorífica
| Experimento - Medios didácticos para experimentar/Almacenamos calor/Capacidad calorífica | |
|---|---|
| (Selecciona [Contraer] para reducir el recuadro, [Expandir] para ver contenido no mostrado). | |
| Autor | MediaHouse GmbH |
| Área | Ciencias Naturales |
| Nivel y/o grado | Básico
|
| Tipo de licencia | CC BY-SA |
| Formato | pdf, doc |
| Responsable de curación | Editor |
| Última actualización | 2016/12/08 |
| Localización | https://medienportal.siemens-stiftung.org/es/experimento-10-a2-almacenamos-calor-107370 |
Por favor, califica el recurso solo si lo has revisado y/o o usado.
Descripción del recurso[editar | editar código]
Primero se ofrece una definición general de la capacidad calorífica. A continuación se destaca la singularidad de la capacidad calorífica del agua y se presenta un método de medición de las capacidades caloríficas, la llamada calorimetría. Por último, se hace referencia a la importancia de la capacidad calorífica para el almacenamiento de calor.
Definición[editar | editar código]
Para calentar una sustancia, es decir, para llevarla de una temperatura más baja a una temperatura más alta, es necesario transferirle calor (Q). Entre mayor sea la diferencia de temperatura objetivo (ᐃT), mayor deberá ser la transferencia de calor, es decir, ambas magnitudes son directamente proporcionales:
Q ᐃ~T
La cantidad exacta de calor necesaria depende de la naturaleza de la sustancia y de su cantidad, o sea, de su masa. La capacidad calorífica C es la relación entre la cantidad de calor transferida y la diferencia de temperatura alcanzada, que cuando está referida a la masa (m) del material se denomina capacidad calorífica específica c = C/m (con frecuencia, para abreviar, se utiliza también de manera equívoca la expresión “calor específico”).
Q CˑᐃT=cˑmˑᐃT
La capacidad calorífica del agua[editar | editar código]
Para calentar 1 °C 1 kg de agua a una temperatura de 20 °C es necesario transferir una cantidad de energía (calor) de 4,183 kJ. Como muestra una comparación con las capacidades caloríficas de otras sustancias, el agua tiene en estado líquido la capacidad calorífica específica más alta. Porque si se quiere, p. ej., aumentar en 1 °C la temperatura de 1 kg de cobre a 20 °C, “solamente” se necesita una cantidad de calor de 0,38 kJ.
| Material | Capacidad calorífica [kJ/kg K] |
| Agua | 4,183 |
| Etanol | 2,4 |
| Madera | 2,5 |
| Hielo (0 °C) | 2,1 |
| Amoniaco | 2,06 |
| Aire | 1,01 |
| Aluminio | 0,9 |
| Cobre | 0,38 |
| Mercurio | 0,14 |
Tabla 1: Valores de referencia para las capacidades caloríficas de líquidos, gases y sólidos. Si no se indica explícitamente otra cosa, los valores se refieren a una temperatura de 20 °C. Los datos para gases corresponden a las capacidades caloríficas a presión constante.[1]
¿Por qué posee el agua líquida una capacidad calorífica tan alta?[editar | editar código]
El motivo por el cual el agua en estado líquido presenta una capacidad calorífica tan alta se explica claramente con el modelo de partículas: las partículas en el modelo de partículas poseen varias posibilidades de movimiento independientes: movimiento rectilíneo (traslación), movimiento giratorio (rotación) y vibración. (En el lenguaje técnico, estas posibilidades de movimiento se denominan “grados de libertad”). Mediante la transferencia de calor es posible excitar todos esos movimientos diferentes. Entre más movimientos diferentes puedan ser excitados, mayor es la capacidad calorífica.
El agua líquida posee un número especialmente elevado de grados de libertad debido a que las moléculas de agua son angulares (varios grados de libertad para rotar), y estas, además de sus propios movimientos de vibración, también interactúan con las vibraciones de otras moléculas. En resumen, todos estos grados de libertad son la causa de la elevada capacidad calorífica del agua líquida.
Así se determina la capacidad calorífica de una sustancia[editar | editar código]
En primer lugar se establece la temperatura y la masa de la sustancia cuya capacidad calorífica se desee determinar. A continuación se transfiere a la sustancia una cantidad de calor definida, se mide la temperatura y se calcula la diferencia de temperatura (ᐃT). La capacidad calorífica específica se determina luego a partir de las magnitudes medidas, por medio de la siguiente ecuación:
c=Q/(mˑᐃT)
Líquidos o gases[editar | editar código]
La determinación experimental de la capacidad calorífica funciona de un modo bastante sencillo, tal y como muestra este ejemplo de la cocina.
Hervir agua para el té: un litro de agua (masa 1 kg) se calienta durante 3 minutos con un hervidor de agua con una potencia eléctrica de 2.000 vatios. La cantidad de calor transferida se puede calcular a partir de la potencia y el tiempo (Q = Pˑt). Se puede medir la temperatura del agua al llenar el hervidor y después de calentarla, y se dispondría entonces de todas las magnitudes para calcular, a partir de ellas, la capacidad calorífica.
Nota: No obstante, este procedimiento conlleva un error de medición más o menos grande. Las causas son la pérdida de calor que se cede al entorno y la absorción de calor por el recipiente del hervidor de agua. Es decir, que si se quiere determinar con exactitud la capacidad calorífica específica del agua, es necesario trabajar con un recipiente extremadamente aislado y conocer su propia capacidad calorífica.
Cuerpos sólidos[editar | editar código]
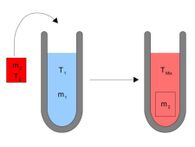
En los sólidos se determina la capacidad calorífica con la ayuda de un calorímetro. Su principio de funcionamiento se basa en el llamado método de las mezclas (v. ecuación 4): Si se ponen en contacto dos cuerpos con diferentes temperaturas, el cuerpo más caliente (m1, T1, c1) cederá calor al cuerpo más frío (m2, T2, c2) hasta que ambos cuerpos tengan la misma temperatura (temperatura de mezcla TMix). Aquí la cantidad de calor cedida por el cuerpo más caliente (Q1) es igual al calor absorbido por el cuerpo más frío (Q2).
Q1 = c1 ˑ m1 ˑ (T1 – TMix) = c2 ˑ m2 ˑ (TMix – T2) = Q2
En el calorímetro se pone la sustancia a medir (m2, T2) en contacto con un baño María (m1, T1). Aquí es importante que el recipiente en el que se encuentra el agua esté bien aislado, cediendo poco calor al exterior. Del agua se conoce la capacidad calorífica, la masa y la temperatura. El agua se calienta ahora durante un tiempo determinado. Una vez finalizada la transferencia de calor, se mide la temperatura (Tmix) del agua.
Si ahora se coloca un sólido en el agua, se comprueba que el baño de agua se enfría, ya que una parte del calor se transmite al cuerpo sólido que se encuentra en el baño María. Cuando se deja de producir un cambio de la temperatura, se dice que el agua y el sólido se encuentran en equilibrio térmico. Se ha alcanzado la temperatura de mezcla TMix y la capacidad calorífica del sólido se puede calcular despejando en la ecuación (4) la capacidad calorífica de la sustancia más fría (c2).
C2 = c1 ˑ m1 ˑ (T1 – TMix)/m2ˑTMix-T2
Aquí también se comete un error, pues no se tienen en cuenta las capacidades caloríficas del calorímetro y del termómetro (denominados juntos CK). Para ser exactos, primero debería determinarse con agua esa capacidad calorífica CK y luego tenerse en cuenta a la hora de calcular la capacidad calorífica específica c2 del sólido. La ecuación quedaría así:
C2 = (c1 ˑ m1+CK)ˑ (T1 – TMix)/m2ˑTMix-T2
Capacidad calorífica y almacenamiento de calor[editar | editar código]
El almacenamiento de energía es un tema muy en auge en el marco de la utilización de energías renovables. Una posibilidad de almacenamiento de la energía es en forma de calor.
Todo el mundo lo conoce de la vida diaria: en invierno, mucha gente se prepara una bolsa de agua caliente para tener toda la noche la cama bien caliente. El calor es almacenado aquí temporalmente en forma de un aumento de la temperatura. Para este tipo de almacenamiento de calor son especialmente adecuadas las sustancias con una gran capacidad calorífica, como el agua, por ejemplo: entre mayor es la capacidad calorífica de una sustancia, menor es la masa necesaria de esa sustancia para almacenar en ella una cantidad de calor determinada (las bolsas de agua caliente tampoco son especialmente grandes por lo general).
Nota: En el almacenamiento de energía en forma de calor a escala industrial, la capacidad calorífica de la sustancia empleada para almacenar calor es un factor más bien secundario. Preferentemente se emplean otras clases de acumuladores, p. ej., acumuladores de calor latente(aquí se almacena calor en forma de una transición de fase) o acumuladores termoquímicos (el calor se almacena en forma de reacciones químicas). Por ejemplo, un acumulador de acetato de sodio con una masa de 100 kg almacena, al fundirse a 58 °C, cinco veces más calor que un acumulador de agua con una masa de 100 kg, al calentarlo de 0 °C a 99 °C.
Comentarios adicionales[editar | editar código]
©Siemens Stiftung 2015, Contenido licenciado bajo CC BY-SA 4.0 internacional
Referencias[editar | editar código]
- ↑ Fuente: Kuchling, 1978
Término utilizado, a menudo, como un saber hacer. Se suele aceptar que, por orden creciente, en primer lugar estaría la habilidad, en segundo lugar la capacidad, y la competencia se situaría a un nivel superior e integrador. Capacidad es, en principio, la aptitud para hacer algo. Todo un conjunto de verbos en infinitivo expresan capacidades (analizar, comparar, clasificar, etc.), que se manifiestan a través de determinados contenidos (analizar algo, comparar cosas, clasificar objetos, etc.). Por eso son, en gran medida, transversales, susceptibles de ser empleadas con distintos contenidos. Una competencia moviliza diferentes capacidades y diferentes contenidos en una situación. La competencia es una capacidad compleja, distinta de un saber rutinario o de mera aplicación.
Destrezas fonológica que consiste en encontrar similitudes y diferencias entre los fonemas o sílabas que forman una palabra.
Conjunto de sonidos articulados con que el hombre manifiesta lo que piensa o siente (DRAE). Facultad que sirve para establecer comunicación en un entorno social, se le considera como un instrumento del pensamiento para representar, categorizar y comprender la realidad, regular la conducta propia y de alguna manera, influir en los demás.
Conjunto de acciones (formas de actuar o de resolver tareas), con un orden, plan o pasos, para conseguir un determinado fin o meta. Se trata de saber hacer cosas, aplicar o actuar de manera ordenada para solucionar problemas, satisfacer propósitos o conseguir objetivos. Forman los contenidos procedimentales.