El condensador, el hidrógeno, el flujo redox (Instrucción para los profesores)
| Experimento - Medios didácticos para experimentar/Experimento 10+/El condensador, el hidrógeno, el flujo redox/El condensador, el hidrógeno, el flujo redox (Instrucción para los profesores) | |
|---|---|
| (Selecciona [Contraer] para reducir el recuadro, [Expandir] para ver contenido no mostrado). | |
| Autor | Dieter Arnold, Burkhard Apell |
| Área | Ciencias Naturales |
| Nivel y/o grado | Básico
|
| Tipo de licencia | CC BY-SA |
| Formato | pdf, doc |
| Responsable de curación | Editor |
| Última actualización | 2019/03/21 |
| Localización | https://medienportal.siemens-stiftung.org/es/experimento-10-b7-el-condensador-el-hidrogeno-el-flujo-redox-107380 |
Por favor, califica el recurso solo si lo has revisado y/o o usado.
Descripción del recurso[editar | editar código]
El experimento consta de tres experimentos parciales:
- El almacenamiento de energía eléctrica en energía química (hidrógeno)
- El almacenamiento directo de energía eléctrica en condensadores
- El almacenamiento de la energía eléctrica en una célula de yoduro de zinc (flujo redox)
La serie de experimentos parciales sobre el almacenamiento de energía, una cuestión de gran actualidad, sirve para abordar un tema de especial importancia para la utilización de energías renovables o regenerativas. Sin embargo, su alcance en el tiempo y respecto al contenido es relativamente amplio. Por ello estos experimentos sirven, sobre todo, en forma de proyecto o en el marco de un día de proyecto dedicado al tema de la transición energética. Debido al amplio alcance es casi imposible que los alumnos y alumnas aborden las bases científicas en los experimentos. Se requieren ciertos conocimientos básicos de Física y Química, algo que pueden verificar muy bien en base a los experimentos. Otra posibilidad consiste en utilizar los experimentos parciales de forma individual para abordar uno de los temas científicos básicos con el ejemplo de una aplicación técnica conocida en la vida cotidiana.
Notas:
- Observe las indicaciones de seguridad incluidas en las instrucciones, así como las normas de seguridad vigentes en el colegio.
- Todos los materiales indicados en las instrucciones deberán adquirirse directamente de fuentes comerciales.
Almacenamos energía renovable[editar | editar código]
La serie de experimentos parciales sobre el almacenamiento de energía, una cuestión de gran actualidad, sirve para abordar un tema de especial importancia para la utilización de energías renovables o regenerativas. Sin embargo, su alcance en el tiempo y respecto al contenido es relativamente amplio. Por ello estos experimentos sirven, sobre todo, en forma de proyecto o en el marco de un día de proyecto dedicado al tema de la transición energética. Debido al amplio alcance es casi imposible que los alumnos y alumnas aborden las bases científicas en los experimentos. Se requieren ciertos conocimientos básicos de Física y Química, algo que pueden verificar muy bien en base a los experimentos. Otra posibilidad consiste en utilizar los experimentos parciales de forma individual para abordar uno de los temas científicos básicos con el ejemplo de una aplicación técnica conocida en la vida cotidiana. Dado que en algunos casos sólo hay dos aparatos disponibles, es conveniente dividir la clase en grupos que realicen diferentes experimentos parciales. Los aparatos y materiales suministrados están disponibles para un número diferente de grupos (véase al respecto el punto 2.4).
Pregunta central[editar | editar código]
El creciente uso de energías renovables constituye un gran desafío técnico para el abastecimiento de energía estacionario: ¿Cómo se puede almacenar de forma efectiva la energía generada cuando hay mucho viento o una radiación solar intensa, a fin de poder suministrarla a través de la red eléctrica cuando haya picos de consumo energético y falta de energía eólica o solar? Junto al hidrógeno como forma de almacenar energía se puede recurrir para ello a unos nuevos acumuladores o baterías, las así llamadas células de flujo redox (de reducción-oxidación).
También la movilidad de las personas nos enfrenta a nuevos retos cada vez mayores a la hora de desarrollar sistemas para almacenar la energía. En este sentido, los coches eléctricos sólo se impondrán en el mercado si sus sistemas de almacenamiento de energía (p. ej., las baterías de litio) hacen posible tener un radio de autonomía comparable al que brinda un tanque de combustible de los motores de combustión de hoy en día.
¡Pero esto no depende únicamente de los acumuladores o las baterías! Los sistemas modernos de transporte metropolitano, así como los trenes de alta velocidad, ya en la actualidad consiguen ahorrar hasta un 30% de la energía de accionamiento gracias a la recuperación de la energía de frenado que se almacena en condensadores.
En los siguientes experimentos se tratarán algunos de los sistemas de almacenamiento de energía adecuados para el abastecimiento de energía móvil y estacionario.
Integrar el experimento en el contexto educativo[editar | editar código]
Base científica[editar | editar código]
Seguramente, los alumnos y alumnas ya habrán tratado en profundidad el concepto de “energía” en otros temas de las ciencias naturales, describiéndola de forma gráfica como la “capacidad para efectuar un trabajo”. Otros planteamientos más ilustrativos explican el término “energía” matizando que se trata de “sistemas que poseen energía y que con ella ponen en movimiento algo, lo levantan, calientan, tiñen o hacen que se ilumine”.
No obstante, la disponibilidad de energía sólo quedará asegurada si también se incluye en la planificación relativa a la demanda previsible de energía unos acumuladores de energía lo suficientemente grandes. Esto lo conoce todo el mundo de los teléfonos celulares, los reproductores MP3, las cámaras digitales, las computadoras portátiles, etc.: Si la batería no está cargada o si no se tienen suficientes pilas o baterías de repuesto, estos aparatos no sirven de nada si no se dispone de corriente eléctrica.
Sin embargo, los alumnos y alumnas quizás no sean conscientes de que los acumuladores de energía también desempeñan un papel importante para los operadores de las redes eléctricas, dado que la producción y el consumo de electricidad con frecuencia se diferencian mucho entre sí en función del tiempo (y del lugar).
Sobre todo en los países industrializados se requiere un abastecimiento seguro de energía eléctrica “las 24 horas del día”. Los operadores de las redes de suministro eléctrico han desarrollado para ello sistemas de compensación asistidos por computadora a fin de que no se les “venga abajo” la red eléctrica en tiempos de excedente o falta de electricidad:
- Cooperaciones con otras redes eléctricas
- Mediante la conexión de centrales propulsadas por gas que se pueden poner en funcionamiento rápidamente
- Utilizando centrales hidroeléctricas de almacenamiento
A medida que aumenta la cuota de energías renovables, que desde el punto de vista de su potencia están sujetas a grandes fluctuaciones (p. ej., los parque eólicos en plataformas situadas en alta mar), dado que en parte no generan electricidad las 24 horas del día (p. ej., la energía solar fotovoltaica), se requiere una amplia aplicación de tecnologías adicionales para el almacenamiento de energía. En realidad, estas tecnologías se conocen desde hace mucho tiempo, pero casi no han encontrado aplicación en la técnica.
Al realizar los experimentos, el objetivo es que los alumnos y alumnas entiendan que con las aplicaciones construyen modelos de sistemas que permiten almacenar energía con principios funcionales que ellos conocen (la electrólisis, los condensadores y las células galvánicas) y al mismo tiempo pueden estudiar su funcionamiento y su ámbito de aplicación.
Relevancia en el plan de estudios[editar | editar código]
El tema “almacenamiento energético” se aborda a partir del grupo de edad de 13 años de forma cualitativa. A partir de los 16 años también se añaden aspectos cuantitativos, como el cálculo del contenido energético y la densidad de potencia de los sistemas de almacenamiento.
En Biología se trata tanto la transformación de la energía luminosa en energía química (la fotosíntesis) como el almacenamiento de la energía excedentaria en forma de hidrocarburos.
En la asignatura de Química se aprovecha con frecuencia el tema del “almacenamiento energético” en el grupo de edad a partir de los 13 años en el contexto de las reacciones endotérmicas y exotérmicas, aunque en un primer plano figura la forma en que tienen lugar las reacciones y en menor medida el almacenamiento energético propiamente dicho. Las lecciones relativas a las baterías y los acumuladores, que pertenecen al ámbito de la reducción-oxidación o de la electroquímica, forman parte integral de casi todos los planes de estudios. A partir de los 16 años se estudian y se realizan experimentos sobre los cambios energéticos desde un punto de vista cualitativo (“la energía es liberada/absorbida”) y cuantitativo (el cálculo del cambio energético en kJ por mol de cantidad de materia) mediante ejemplos de reacción adecuados.
En la asignatura de Física se aborda el “almacenamiento energético” en el ámbito temático general del “abastecimiento energético”. A partir de los 16 años por lo general sólo se estudia el condensador en mayor grado de detalle.
Temas y terminología: El ánodo, la célula de combustible, el condensador de doble capa, la dirección de giro, el depósito de aire comprimido, la electroquímica, el electrolito, el condensador electrolítico, el motor eléctrico, la electroestática, las reacciones endotérmicas y exotérmicas, el acumulador energético, la transformación de energía, el abastecimiento energético, las energías renovables, las células galvánicas, la central eléctrica de gas, el gel como electrolito, la prueba con astilla incandescente, el condensador de doble capa “gold cap”, el cátodo, la reacción de gas oxhídrico, el condensador, la central eléctrica, la carga y descarga (de baterías), la densidad de potencia, la polarización, la célula de flujo redox, las energías renovables o regenerativas, el oxígeno, el motor solar, el tanque de combustible, la central hidroeléctrica de almacenamiento, el hidrógeno, la turbina de viento
Conocimientos a adquirir[editar | editar código]
Los alumnos y alumnas ...
- pueden describir la formación de hidrógeno (en el polo negativo) y oxígeno (en el polo positivo) en la electrólisis de agua o con una solución de carbonato de sodio (“solución sódica”).
- son capaces de describir la explosión del gas oxhídrico como prueba del hidrógeno y el ensayo de la astilla incandescente como prueba del oxígeno.
- pueden describir la conversión de hidrógeno y oxígeno en agua en una “célula de combustible”.
- entienden la electrólisis como reacción endotérmica y los procesos en la célula de combustible como reacción exotérmica.
- comprenden el funcionamiento de una célula electrolítica como posible forma de almacenar la energía eólica, teniendo en cuenta que se obtiene hidrógeno (energía química) a partir de la energía eólica, que a través de las células de combustible se puede volver a transformar en energía eléctrica.
- conocen los condensadores para almacenar la energía eléctrica, comprueban experimentando las propiedades cualitativas y cuantitativas y nombran los ámbitos de aplicación.
- reconocen la célula de flujo redox como una forma ampliada de la célula electrolítica y entienden cómo funciona el almacenamiento de energía eléctrica en energía química.
El experimento en el contexto explicativo[editar | editar código]
El almacenamiento de energía eléctrica en energía química(hidrógeno)[editar | editar código]
Hay dos células electrolíticas disponibles, o sea que como máximo pueden experimentar con ella dos grupos de alumnos a la vez.
Este experimento parcial es un ensayo modelo sobre la tecnología del hidrógeno, en la que la energía eléctrica excedentaria se almacena en forma de hidrógeno (como energía química) y en caso de demanda energética se vuelve a convertir en energía eléctrica en centrales eléctricas de gas o en células de combustible.
Según el conocido principio de la electrólisis, a partir de una solución sódica saturada se forman hidrógeno y oxígeno al añadir energía eléctrica. El carbonato de sodio disuelto (o natrón) sirve aquí de electrolito, que tiene la propiedad de reducir la tensión necesaria. No se consume durante la reacción.
En los electrodos se produce la siguiente reacción:
| En el polo negativo (el cátodo): | 4H2O + 4e– | → | 2H2 + 4OH– |
| En el polo positivo (el ánodo): | 4OH– | → | O2 + 2H2O + 4e– |
| Reacción total: | 2H2O + energía | → | 2H2 + O2 |
Es posible comprobar los gases emitidos mediante experimentos sencillos: El hidrógeno haciendo la prueba de explosión del gas oxhídrico y el oxígeno mediante la prueba de la astilla incandescente.
En los recipientes colectores sobre los electrodos se puede reconocer la relación de volumen de los gases que se han formado: dos partes en volumen de hidrógeno por una de oxígeno.
Cuando los electrodos de grafito estén rodeados de suficiente hidrógeno y oxígeno, la célula hará las veces de célula de combustible durante unos breves instantes: El hidrógeno y el oxígeno se convertirán nuevamente en agua y energía eléctrica y el motor conectado se moverá.
En los electrodos tienen lugar las siguientes reacciones:
| En el polo negativo (el cátodo): | 2H2 + 4OH– | → | 4H2O + 4e- |
| En el polo positivo (el ánodo): | O2 + 2H2O + 4e- | → | 4OH- |
| Reacción total: | 2H2 + O2 | → | 2H2O + energía |
Si se conectan células solares a la cámara electrolítica, sólo se verá cómo empieza a formarse el gas en los electrodos al añadir la cuarta célula. La tensión de descomposición se sitúa aproximadamente en 2 V.
Si se utiliza el motor solar al soplar y accionar así la turbina de viento (el generador) y se lo conecta a la cámara electrolítica, la energía eléctrica generada hace que se formen hidrógeno y oxígeno. El motor solar también funciona como consumidor con la misma dirección de giro de la hélice, dado que la polarización de los electrodos sigue siendo la misma.
La energía eléctrica se almacena en la célula electrolítica como energía química (hidrógeno y oxígeno). El hidrógeno así obtenido se podría añadir al gas natural y ser transportado a través de los gasoductos hasta los consumidores, donde podría volver a ser utilizado para “generar energía”. O bien el hidrógeno se podría almacenar en tanques de forma estacionaria y, en caso de que se necesite la electricidad, se podría volver a convertir en corriente eléctrica utilizando las células de combustible. El oxígeno es un reactivo químico apreciado y se puede vender muy bien (p. ej., a las depuradoras de aguas residuales). Es posible liberar el oxígeno al aire y volver a quitarlo del aire si fuera necesario.
El almacenamiento directo de energía eléctrica en condensadores[editar | editar código]
En la caja de experimentación se suministran en total cuatro condensadores de doble capa y ocho células solares, o sea que como máximo pueden experimentar dos grupos de alumnos a la vez.
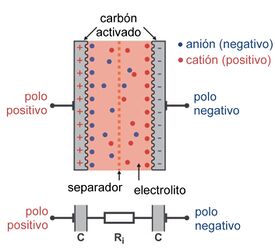
El condensador es la única posibilidad de almacenar la energía eléctrica directamente en forma de portadores de carga. En este experimento parcial se utiliza para almacenar la energía un condensador de doble capa especialmente potente. Este condensador de doble capa se compone de dos capas con carbón activado (=grafito) que están separadas entre sí por electrolitos orgánicos. Para la carga se aplica una tensión en los dos electrodos de carbón activado. Entonces, los aniones negativos del electrolito se moverán hacia el electrodo de carga positiva y los cationes positivos hacia el electrodo de carga negativa.
Delante de los electrodos de carbón se forman dos zonas de portadores de carga inmóviles de diferente signo. De esta forma se crean dos condensadores conectados uno detrás del otro en los que los electrodos son cada uno de grafito.
Así se explica la denominación de condensador de doble capa. En el medio del condensador se encuentra el separador permeable a los iones que ha de impedir un contacto entre los electrodos. La capacidad de un condensador depende básicamente del tamaño de la superficie de los electrodos. Debido a la superficie extremadamente grande del carbón poroso activado, este tipo de condensadores tiene una máxima capacidad aún con un volumen muy pequeño.
Los condensadores almacenan la energía suministrada de forma electroestática, es decir, en forma de electrones, a diferencia del almacenamiento electroquímico de energía (en baterías o acumuladores).
Si se carga el condensador durante un minuto con cuatro células solares conectadas en serie, entonces el motor solar se moverá durante aproximadamente 2 minutos y el diodo LED se iluminará durante unos 10 minutos, lo que se explica por el bajo consumo de electricidad del diodo.
Al soplar se mueve el motor (la turbina eólica) y también se carga el condensador. Dado que la polarización se mantiene el motor se seguirá moviendo en la misma dirección cuando se descargue el condensador. Si se sopla con más fuerza durante unos 5 segundos y si se para un momento el movimiento de la hélice, el motor debería seguir girando durante 5 segundos.
Los condensadores podrían almacenar la energía de frenado en, p. ej., las bicicletas ya equipadas con un acumulador y un motor eléctrico (las así llamadas “bicis eléctricas”) para que si fuera necesario pueda volver a ser utilizada esa energía para acelerar al arrancar la bicicleta. Esta tecnología desde hace mucho tiempo encuentra aplicación en los trenes de alta velocidad así como en los sistemas de transporte metropolitano.
El almacenamiento de la energía eléctrica en una célula de yoduro de zinc (flujo redox)[editar | editar código]
Hay a disposición dos células electrolíticas, o sea que como máximo pueden experimentar con ella dos grupos de alumnos a la vez.
Este experimento parcial es un ensayo modelo para reproducir una célula de flujo redox en la que se extrae la materia formada en la electrólisis (reacción endotérmica) y se almacena en tanques separados. En caso de necesitar la energía, esa materia se vuelve a utilizar para producir energía eléctrica según el principio de la célula galvánica (reacción exotérmica). Este tipo de célula se está poniendo a prueba para su aplicación en parques eólicos.
La reacción química que tiene lugar al cargar una célula de yoduro de zinc es la siguiente:
En el polo negativo (el cátodo):
En el polo positivo (el ánodo):
Zn2+ + 2e–
2 I–
→ Zn
→ I2 + 2e–
En el ánodo se observa una coloración marrón tras un breve período de carga debido al yodo que se forma. La deposición de zinc en el cátodo es difícil de reconocer. En nuestro experimento trabajamos con un electrolito gelificado estacionario. En las verdaderas células de flujo redox se forman sustancias solubles en el cátodo y en el ánodo que se pueden bombear en forma líquida y de esa forma es posible almacenarlas en tanques separados. Los tanques son baratos y es posible almacenar cualquier cantidad que se desee. Además, en este sistema teóricamente es posible realizar todos los ciclos de carga y descarga que se quiera.
La reacción química que tiene lugar al descargar una célula de yoduro de zinc es la siguiente:
En el polo negativo (el cátodo):
En el polo positivo (el ánodo):
Zn
I2 + 2e–
→ Zn2+ + 2e–
→ 2 I–
Atención: Si se carga mucho la célula de yoduro de zinc y con mucha frecuencia una detrás de la otra, ya no desaparece el color marrón en la descarga, lo que molesta a algunos profesores por motivos didácticos. Sin embargo, esto no es un efecto permanente (véase a este respecto el capítulo 4.5.2).
La dirección de giro del motor no cambia, dado que la polarización sigue siendo la misma. Cuando hay mucha radiación solar el motor se mueve durante aproximadamente dos minutos con un tiempo de carga de un minuto.
Variantes de ejecución[editar | editar código]
Dado que el material suministrado es suficiente solamente para cuatro grupos de trabajo, el experimento parcial 1 deberían hacerlo los grupos 1 y 2 y los experimentos parciales 2 y 3 los grupos 3 y 4.
Si hay tiempo suficiente, los grupos pueden intercambiar el material y realizar los experimentos del otro grupo. Lo importante es que los grupos comparen los resultados entre sí.
Los dos motores solares pequeños (2 mA) y las ocho células solares están a disposición de los cuatro grupos de trabajo.
Informaciones adicionales sobre el experimento[editar | editar código]
Para preparar y/o profundizar este experimento encontrará información complementaria en el Portal de Medios de la Siemens Stiftung: https://medienportal.siemens-stiftung.org (Entre otros, encontrará una animación flash sobre la electrólisis del agua y el funcionamiento de la célula de combustible)
Otros posibles experimentos:
Aparte de los sistemas de almacenamiento presentados, con pocos medios también se puede abordar el funcionamiento de las centrales hidroeléctricas de almacenamiento y las centrales de almacenamiento de aire comprimido.
- Centrales hidroeléctricas de almacenamiento: Un vaso lleno de agua se coloca sobre un armario. El agua que baja por una manguera acciona una turbina de agua.
- Centrales de almacenamiento de aire comprimido: Se infla un globo y se utiliza para accionar una turbina de viento.
Observaciones sobre la realización del experimento[editar | editar código]
Lugar en el que se realiza el experimento[editar | editar código]
No se requiere un lugar especial para realizar los experimentos.
Tiempo necesario[editar | editar código]
| Preparación, realización, evaluación y debate | |
| Experimento parcial 1 | 60 min. |
| Experimento parcial 2 | 60 min. |
| Experimento parcial 3 | 60 min. |
| Realización de todos los experimentos en bloque | 180 min. |
Advertencias de seguridad[editar | editar código]
Los experimentos sólo pueden ser realizados bajo la vigilancia del profesor o de la profesora.
Hay que advertir a los alumnos y alumnas que los materiales suministrados sólo se deben utilizar siguiendo las instrucciones correspondientes. En estos experimentos tenga en cuenta los siguientes peligros y llame la atención de los alumnos y alumnas a este respecto:
- En el experimento parcial 1 los alumnos y alumnas deben llevar gafas de protección. Llame la atención de los alumnos y alumnas respecto a las medidas de primeros auxilios en caso de que se salpiquen con carbonato de sodio o con solución sódica en los ojos o sobre la piel (alcanza con enjuagarse en seguida con agua).
Según la nueva normativa internacional GHS sobre sustancias peligrosas: “Atención”
- Hay peligro de quemaduras y de incendio al trabajar con fuego. Antes de utilizar por primera vez los encendedores el profesor o la profesora tiene que controlar que funcionen bien, especialmente para regular la altura de la llama.
- Las células electrolíticas tienen que ser eliminadas correctamente. Es conveniente que el profesor o la profesora guarde la solución sódica ya que se puede volver a utilizar una y otra vez.
- Experimento parcial 3: La célula de yoduro de zinc no se debe desmontar porque si no ya no funcionará y podrían salir sustancias químicas que causan irritaciones.
Aparatos y materiales[editar | editar código]
A adquirir o preparar previamente:
- Solución sódica: Por motivos de seguridad, el profesor o la profesora debería preparar antes de empezar el experimento aprox. 500 m. de carbonato de sodio saturado en un recipiente de almacenamiento adecuado (véase también la indicación relativa a la lista de materiales).
- Tiras de cartón para montar las células solares
- Reloj (alcanza con un reloj de pulsera con segundero)
- En caso de que no haya suficiente luz del sol, debería disponerse de lámparas de mesa o similares con focos halógenos de al menos 20 W.
- Por grupo de alumnos: un encendedor (de ser posible un encendedor de chispa) o fósforos.
Incluido en el suministro:
Según el experimento parcial los aparatos y materiales alcanzan para que dos a cuatro grupos de alumnos realicen los experimentos en paralelo.
El cableado y la utilización correctos del multímetro, los LED y el motor es algo que debería aclarar el profesor de antemano en función de los conocimientos de los alumnos y alumnas, si hace falta haciendo una demostración.
Los materiales y aparatos importantes para la seguridad deben ser controlados antes de entregárselos a los alumnos y alumnos para comprobar que funcionen correctamente.
Para un grupo de alumnos se requieren los siguientes materiales de la caja:
| Material | Cantidad |
| Banda elástica | 4x |
| Cable conector de cocodrilo | 7x |
| Célula de yoduro de zinc | 1x (sólo para 2 grupos) |
| Célula electrolítica** | 1x (sólo para 2 grupos |
| Célula solar, 0,5 V/150 mA | 4x (sólo para 2 grupos) |
| Clip para plantas (para fijar el tubo de ensayo) | 2x |
| Condensador de doble capa “gold cap”, 0,22 F | 1x |
| Gafas protectoras*** | 1x |
| Hélice doble para el motor solar pequeño | 1x |
| Jabón (carbonato de sodio), paquete**** | 1x |
| Jeringuilla Luer Lock, 10 ml (como recipiente colector) | 3x (sólo para 2 grupos) |
| Juego de cable de medición banana/cocodrilo, en rojo y negro,
respectivamente |
1x |
| LED rojo (caja roja), 5 V | 1x |
| Llave de agua individual (que encaje en una manguera de 7/4 mm y tapa Luer Lock) | 2x (sólo para 2 grupos) |
| Manguera de silicona 7/4 mm, 3,5 m (que encaje en una tapa Luer Lock) (la primera vez hay que cortar pedazos de 3,5 cm) | 1x |
| Motor solar pequeño, 0,1 V/2 mA | 1x para toda la clase |
| Multímetro digital | 1x |
| Pila, 9 V* | 1x |
| Tijera | 1x |
| Tubo de ensayo de plástico (PP), mini | 2x (sólo para 2 grupos) |
*Hay que procurar que las pilas estén cargadas, después de usarlas en seguida hay que cargarlas nuevamente. En la caja de experimentación hay un cargador de pilas.
**La célula electrolítica es suministrada como parte de un juego (vaso, 2 electrodos de grafito, 2 pedazos de alambre, 2 pedazos de manguera) y debe ser montada por el primer grupo de alumnos (las instrucciones están en el documento de orientación para los alumnos).
***En total se suministran 16 gafas protectoras para todos los alumnos y alumnas en todos los grupos. Si participaran más alumnos y alumnas en los experimentos, si hace falta hay que conseguir gafas protectoras de la escuela.
****Atención: En la caja de experimentación se suministra un paquete de carbonato de sodio. Pero no es muy razonable que los alumnos preparen ellos la solución sódica que se requiere para el experimento. Sobre todo, porque la solución se puede volver a utilizar una y otra vez. Por esta razón y para preparar el experimento parcial 4, el profesor debería preparar aprox. 500 ml de solución saturada de carbonato de sodio. (A una temperatura de 20ºC se disuelven como máximo 217 g de carbonato de sodio en un litro de agua). La solución tiene que dejarse lista en un recipiente que se pueda tapar bien. Después de realizar los experimentos los alumnos y alumnas pueden volver a verter nuevamente la solución de carbonato de sodio en el recipiente con tapa.
Poner orden, eliminar residuos, reciclar[editar | editar código]
Generalidades[editar | editar código]
Todos los aparatos y casi todos los materiales suministrados en la caja se pueden reutilizar.
Por ello debería asegurarse de que al concluir cada experimento coloquen todo nuevamente en la caja correspondiente. Así estará seguro de que Ud. y sus compañeros de trabajo encuentren todo rápidamente cuando lo quieran volver a utilizar.
Los aparatos que se hayan ensuciado al realizar los experimentos, como, p. ej., vasos, recipientes, cucharas, tubos de ensayo, deberían ser limpiados antes de colocarlos en las cajas. Lo más fácil es que los alumnos y alumnas se ocupen de hacerlo al finalizar el experimento.
Además, asegúrese de que los aparatos estén listos para ser utilizados en la próxima ocasión.
Por ejemplo, hay que poner a cargar las pilas usadas (También es recomendable cuando no se han usado las pilas desde hace tiempo.).
Los materiales no reciclables como, p. ej., los palitos de medición del valor pH o el papel de filtro, deben ser tirados a la basura correcta.
Los residuos resultantes de este experimento se pueden tirar a la basura normal o por el desagüe.
Para la regeneración de la célula de yoduro de zinc[editar | editar código]
Al cargar la célula de yoduro de zinc se forman yodo atómico y zinc. En particular, se puede ver muy bien cómo el yodo forma una “nube” marrón alrededor del electrodo positivo. Este fenómeno es muy importante desde un punto de vista didáctico, dado que se puede observar en seguida el resultado del proceso de carga. Sin embargo, al descargar la célula de yoduro de zinc con el motor eléctrico no desaparece por completo el color marrón del yodo. Para acelerar la descarga y, con ello, que desaparezca el color, debería hacerse un cortocircuito con los dos electrodos de la célula, utilizando el cable de conexión de cocodrilo. Según el estado de carga de la célula, se requerirán entonces pocas horas hasta como máximo tres días hasta que desaparezca por completo el color. La razón de esta lenta descarga es la siguiente: El yodo se difunde demasiado lejos del electrodo, como para poder hacer que se reduzca nuevamente a I– (incoloro). Por lo tanto, se requiere bastante tiempo hasta que el yodo difundido llegue a las partículas metálicas del zinc (el cortocircuito interno) y que éste reaccione hasta convertirse en yoduro de zinc incoloro. En un caso dado no hay que esperar varios días hasta poder repetir el experimento. Incluso cuando todavía queda un poco de color marrón, la célula se puede cargar y descargar en todo momento (sólo se pierde el efecto visible del cambio de coloración)
Comentarios adicionales[editar | editar código]
©Siemens Stiftung 2016, Contenido licenciado bajo CC BY-SA 4.0 internacional
Las “promesas” que los miembros de un equipo hacen uno al otro sobre su comportamiento.
Término utilizado, a menudo, como un saber hacer. Se suele aceptar que, por orden creciente, en primer lugar estaría la habilidad, en segundo lugar la capacidad, y la competencia se situaría a un nivel superior e integrador. Capacidad es, en principio, la aptitud para hacer algo. Todo un conjunto de verbos en infinitivo expresan capacidades (analizar, comparar, clasificar, etc.), que se manifiestan a través de determinados contenidos (analizar algo, comparar cosas, clasificar objetos, etc.). Por eso son, en gran medida, transversales, susceptibles de ser empleadas con distintos contenidos. Una competencia moviliza diferentes capacidades y diferentes contenidos en una situación. La competencia es una capacidad compleja, distinta de un saber rutinario o de mera aplicación.
Provoca irritaciones en los ojos.
No debe respirarse: polvo / humo / gas / niebla / vapor / aerosol.
Reacción al entrar en contacto con los ojos.
(ojos) Enjuagarse con cuidado los ojos durante algunos minutos.
Si es posible, retirar los lentes de contacto en caso de llevarlos puestos. Seguir enjuagando.